Baiklah sobat kali ini kita akan membahas mengenai Perkembangan Sistem Periodik Unsur meliputi Triade Dobereiner, Teori Oktaf Newland, Sistem Periodik Mendeleev, dan Sistem Periodik Modern
Setiap saat, unsur-unsur kimia gres semakin banyak ditemukan oleh para jago sehingga menjadikan kesulitan dalam mempelajarinya. Oleh lantaran itu, dibuatlah pengelompokan sehingga unsur-unsur tersebut sanggup tertata dengan baik sehingga lahirlah sistem periodik unsur. Sistem periodik unsur mengandung hampir semua informasi ihwal sifat-sifat unsur yang sekarang berjumlah tidak kurang dari 118, yang mencakup unsur alam dan sintesis.
Perkembangan Sistem Periodik Unsur
Upaya untuk mengelompokkan unsur-unsur ke dalam kelompok-kelompok tertentu bekerjsama sudah dilakukan para jago semenjak dulu, tetapi pengelompokan masa itu masih sederhana. Pengelompokan yang paling sederhana ialah membagi unsur ke dalam kelompok logam dan non-logam.
1. Triade Dobereiner
Seiring perkembangan ilmu kimia, perjuangan pengelompokan unsur-unsur yang semakin banyak tersebut dilakukan oleh para jago dengan banyak sekali dasar pengelompokan yang berbeda-beda, tetapi tujuan balasannya sama, yaitu mempermudah dalam mempelajari sifat-sifat unsur. Dimulai pada tahun 1829, Johan Wolfgang Dobereiner mengelompokkan unsur-unsur yang sangat menyerupai sifatnya. Ternyata tiap kelompok terdiri dari tiga unsur, sehingga kelompok itu disebut triad. Apabila unsur-unsur dalam satu triad disusun berdasarkan kenaikan massa atom relatifnya, ternyata massa atom maupun sifat-sifat unsur yang kedua merupakan rata-rata dari massa atom relatif maupun sifat-sifat unsur pertama dan ketiga.
Triade 1 | Triade 2 | Triade 3 | Triade 4 | Triade 5 |
Li | Ca | S | Cl | Mn |
Na | Sr | Se | Br | Cr |
K | Ba | Te | I | Fe |
Sistem triad ini mempunyai kelemahan yaitu kurang efisien lantaran ada beberapa unsur lain yang tidak termasuk dalam satu triad tetapi mempunyai sifat-sifat menyerupai dengan triade tersebut.
2. Teori Oktaf Newland
John Alexander, pada tahun 1864 menyusun ulang daftar unsur yang berjumlah lebih banyak. Susunan Newland menunjukkan bahwa bila unsur-unsur disusun berdasarkan kenaikan massa atomnya, maka unsur pertama punya kemiripan sifat dengan unsur kedelapan, unsur kedua dengan unsur kesembilan, dan seterusnya. Penemuan Newland ini dinyatakan sebagai Hukum Oktaf Newland.
1 | 2 | 3 | 4 | 5 | 6 | 7 |
H F Cl Co dan Ni Br | Li Na K Cu Rb | Be Mg Ca Zn Sr | B Al Cr Y Cs dan La | C Si Ti In Zr | N P Mn As Bi & Mo | O S Fe Se Po dan Ru |
Pada ketika daftar Oktaf Newland ini disusun, unsur-unsur gas mulia (He, Ne, Ar, Kr, Xe, dan Rn) belum ditemukan. Gas mulia ditemukan oleh Rayleigh dan Ramsay pada tahun 1984. Unsur gas mulia yang pertama ditemukan ialah gas argon.
Hukum oktaf ini mempunyai kelemahan lantaran hanya berlaku untuk unsur-unsur ringan. Jika diteruskan, ternyata kemiripan sifatnya terlalu dipaksakan. Misalkan, Zn mempunyai sifat yang cukup berbeda dengan Be, Mg, dan Ca.
3. Sistem Periodik Mendeleev
 |
| Dmitri Mendeleev |
Dmitri Ivanovich Mendeleev pada tahun 1869, menciptakan kesimpulan dari unsur kimia yang sudah ditemukan pada ketika itu bahwa sifat-sifat unsur ialah fungsi periodik dari massa atom relatifnya dan persamaan sifat. Artinya, bila unsur-unsur disusun berdasarkan kenaikan massa atom relatifnya, maka sifat tertentu akan berulang secara periodik. Mendeleev menempatkan unsur-unsur yang mempunyai kemiripan sifat dalam satu lajur vertikal, yang disebut golongan. Lajur-lajur horizontal, yaitu lajur unsur-unsur berdasarkan kenaikan massa atom relatifnya, disebut periode.
 |
| Tabel Periodik Mendeleev |
Hal yang penting dalam sistem periodik Mendeleev adalah:
- Dua unsur yang berdekatan, massa atom relatifnya mempunyai selisih paling kurang dua atau satu satuan;
- Terdapat kotak kosong untuk unsur yang belum ditemukan, menyerupai 44, 68, 72, dan 100;
- Dapat meramalkan sifat unsur yang belum dikenal menyerupai ekasilikon;
- Dapat mengoreksi kesalahan pengukuran massa atom realtif beberapa unsur contohnya Cr = 52,0 bukan 43,3.
Kelebihan sistem periodik Mendeleev:
- Sifat kimia dan fisika unsur dalam satu golongan menyerupai dan berubah secara teratur
- Valensi tertinggi suatu unsur sama dengan nomor golongannya
- Dapat meramalkan sifat unsur yang belum ditemukan pada ketika itu dan telah mempunyai daerah yang kosong.
Kekurangan sistem periodik Mendeleev:
- Panjang periode tidak sama dan sebabnya tidak sanggup dijelaskan
- Beberapa unsur tidak disusun berdasarkan kenaikan massa atomnya, contohnya Te (128) sebelum I (127).
- Selisih massa unsur yang berurutan tidak selalu 2, tetapi berkisar antara 1 dan 4 sehingga sukar meramalkan massa unsur yang belum diketahui secara tepat
- Valensi unsur yang lebih dari saru sulit diramalkan dari golongannya
- Anomali (penyimpangan) unsur hidrogen dari unsur lain tidak dijelaskan.
4. Sistem Periodik Modern
Kurang lebih 45 tahun berikutnya, tepatnya pada tahun 1914, Henry G. Moseley (1887 – 1915) menemukan bahwa urutan unsur dalam sistem periodik sesuai dengan kenaikan nomor atom unsur. Penempatan telurium (Ar = 128) dan iodin (Ar = 127) yang tidak sesuai dengan kenaikan massa atom relatif, ternyata sesuai dengan kenaikan nomor atomnya (nomor atom Te = 52; I = 53). Jadi, sifat periodik lebih sempurna dikatakan sebagai fungsi nomor atom. Sistem periodik unsur modern disusun berdasarkan kenaikan nomor atom dan kemiripan sifat. Sistem periodik unsur modern merupakan penyempurnaan dari sistem periodik Mendeleev.
 |
| Sitem Periodik Modern |
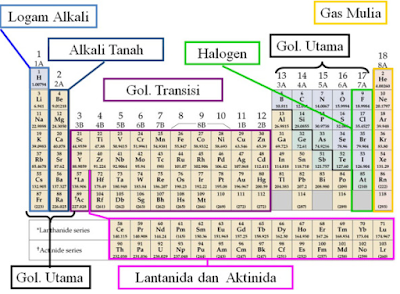
Sistem periodik modern dikenal juga sebagai sistem periodik bentuk panjang, disusun berdasarkan kenaikan nomor atom dan kemiripan sifat. Dalam sistem periodik modern terdapat lajur mendatar yang disebut periode dan lajur tegak yang disebut golongan.
Jumlah periode dalam sistem periodik ada 7 dan diberi tanda dengan angka:
- Periode 1 disebut sebagai periode sangat pendek dan berisi 2 unsur
- Periode 2 disebut sebagai periode pendek dan berisi 8 unsur
- Periode 3 disebut sebagai periode pendek dan berisi 8 unsur
- Periode 4 disebut sebagai periode panjang dan berisi 18 unsur
- Periode 5 disebut sebagai periode panjang dan berisi 18 unsur
- Periode 6 disebut sebagai periode sangat panjang dan berisi 32 unsur, pada periode ini terdapat unsur Lantanida, yaitu unsur nomor 58 hingga nomor 71 dan diletakkan pada penggalan bawah.
- Periode 7 disebut sebagai periode belum lengkap lantaran mungkin akan bertambah lagi jumlah unsur yang akan mengisi periode ini. Sampai ketika ini ada 24 unsur yang menduduki periode ini. Periode ini mempunyai deretan unsur yang disebut aktinida, yaitu unsur bernomor 90 hingga nomor 103 dan diletakkan pada penggalan bawah.
Jumlah golongan dalam sistem periodik ada 8 dan ditandai dengan angka Romawi. Ada dua golongan besar, yaitu golongan A (golongan utama) dan golongan B (golongan transisi). Golongan B terletak antara golongan IIA dan golongan IIIA.
Nama-nama golongan pada unsur golongan A
- Golongan IA disebut golongan alkali
- Golongan IIA disebut golongan alkali tanah
- Golongan IIIA disebut golongan boron
- Golongan IVA disebut golongan karbon
- Golongan VA disebut golongan nitrogen
- Golongan VIA disebut golongan oksigen
- Golongan VIIA disebut golongan halogen
- Golongan VIIIA disebut golongan gas mulia
Pada periode 6 golongan IIIB terdapat 14 unsur yang sangat menyerupai sifatnya, yaitu unsur-unsur lantanida. Pada periode 7 juga berlaku hal yang sama dan disebut unsur-unsur aktinida. Kedua seri unsur ini disebut unsur-unsur transisi dalam. Unsur-unsur lantanida dan aktinida termasuk golongan IIIB, dimasukkan dalam satu golongan lantaran mempunyai sifat yang sangat mirip.
Inilah postingan mengenai Perkembangan Sistem Periodik Unsur, biar bermanfaat bagi sobat semua dan jangan lupa bagikan ke teman-teman sobat yang membutuhkan informasi ini. J